روشهای تولید هیدروژن از طریق فرایند الکترولیز
15 بهمن 1402
تهیهکنندگان: فرامرز سرلک و محمد آفریده
در سالهای اخیر، نگرانیها در مورد استفاده ناپایدار ازسوخت های فسیلی و گرمایش جهانی به دلیل افزایش تقاضای جهانی انرژی در نتیجه رشد مداوم جمعیت و سبک زندگی با مصرف انرژی زیاد افزایش یافته است. توسعه منابع انرژی تجدیدپذیر درتسریع گذار انرژی به سمت کاهش انتشار جهانی کربن ضروری است. هیدروژن به عنوان یک حامل انرژی مسیری بهینه جهت کاهش تغییرات آب و هوایی از طریق ترکیب برق تجدیدپذیر با سیستمهای الکترولیز آب معرفی شده است. امروزه، الکترولیز هیدروژن به عنوان یک روش موثر و فراگیر نسبت به سایر روشهای تولید هیدروژن در سطح جهان مورد استفاده قرار گرفته است. تولید هیدروژن سبز راهحلی بهینه برای کاهش اثرات زیست محیطی گازهای گلخانهای میباشد. با این حال، الکترولیز آب نیاز به مصرف انرژی بالاتری دارد. مصرف انرژی الکترولایزر صنعتی 4.5 تا 5 کیلو وات ساعت بر متر مکعب میباشد. مصرف انرژی بالا یک چالش اساسی است که باید برای به حداقل رساندن هزینه های تولید هیدروژن مورد توجه قرار گیرد.
در فرآیند الکترولیز آب از چهار روش اساسی استفاده میشود:
- - الکترولیز آب قلیایی
- - الکترولیز غشای تبادل پروتون
- - الکترولیز اکسید جامد
- - الکترولیز غشای تبادل آنیونی
1. الکترولیز آب قلیایی
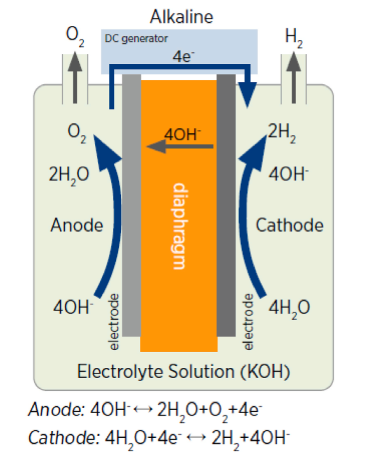
الکترولیزهای آب قلیایی معمولاً برای تولید هیدروژن در کاربردهای بزرگ استفاده میشود. اکسیدهای نیکل و کبالت به ترتیب برای تشکیل مواد آند و کاتد استفاده میگردند. علاوه بر این، الکترولیت هیدروکسید پتاسیم با 30 تا 40% قابل استفادهترین الکترولیت بوده و با گردش الکترولیت در هر دو الکترود، بیشترین خاصیت قلیاییبودن آن ایجاد میشود ]1 و 2[. در شکل 1 نمودار شماتیک یک سلول الکترولیز آب قلیایی را نشان داده شده است که در آن واکنشهای آند و کاتد برای تولید هیدروژن و اکسیژن رخ میدهد. دیافراگم متخلخل جداکننده بین دو الکترود نصب میشود و هیدروکسیدها تولید و از مواد متخلخل دیافراگم که از مواد اکسید سرامیکی مانند آزبست و پلیمرها ساخته شدهاند، عبور میکنند ]3 و 4[. هیدروژن و هیدروکسید در کاتد در دمای عملیاتی متوسط 65 تا 100 درجه سانتیگراد تولید میگردند. سپس با واکنش هیدروکسید اکسیژن در آند تولید میشود. راندمان تبدیل الکترولیزهای آب قلیایی 60 تا 80 درصد و ولتاژ کار سلول 1.8 تا 2.4 ولت است ]5[. از مزایای الکترولیزهای قلیایی میتوان به این مورد اشاره نمود که این فرایند در دماهای پایین کار کرده و برای فعال شدن و تولید هیدروژن نیازی به کاتالیزور ندارند]6[. در مقابل، خوردگی الکترود در الکترولیز قلیایی، به دلیل وجود محلول قلیایی مهمترین چالش در این فرایند در نظر گرفته می شود.
 |
|
|
|
شکل 1 شماتیک الکترولیز قلیایی آب برای تولید هیدروژن |
2. الکترولیز غشای تبادل پروتون
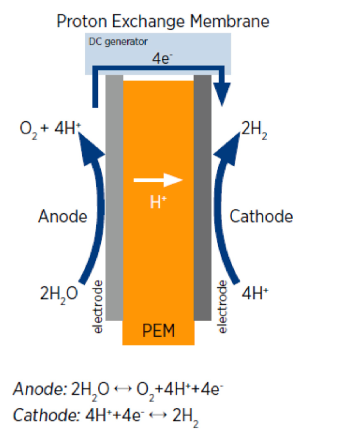
این دسته از الکترولیزهای آب می توانند هیدروژن با خلوص بالا را در محدوده دمای پایین 70 تا 90 درجه سانتیگراد تولید کنند. ایریدیم اکسید و پلاتین به ترتیب به عنوان مواد کاتالیزور آند و کاتد استفاده میشوند ]7 و 8[. غشای نفیون به طور معمول برای هدایت یون های هیدروژن به عنوان یک الکترولیت جامد بر خلاف الکترولیت مایع در الکترولیزهای قلیایی استفاده میگردد. شکل شماتیک سلول الکترولیز غشای تبادل پروتون و مکانیسم واکنش در شکل 2 نشان داده شده است. یون های هیدروژن از طریق غشای جامد عبور کرده و مولکولهای هیدروژن را تشکیل میدهند. به دلیل ماهیت اسیدی الکترولیت و سطوح فلزی الکترود، سینتیک واکنش این الکترولیزها در مقایسه با سلول های قلیایی به سرعت القا می شود ]9[. در نتیجه، این دسته از الکترولایزرها ایمنتر بوده و میتوانند در فشار اتمسفر در سمت آند کار کنند. در حالی که سمت کاتد در معرض فشارهای بالاتری قرار دارند ]10[. بنابراین، تجزیه و تحلیل گسترده ای باید انجام شود تا ویژگی های واحد در مقیاس بزرگ و طول عمر مورد انتظار این الکترولیزها مورد تایید قرار گیرد.
 |
||
|
|
|
شکل 2 شماتیک الکترولیز غشای تبادل پروتون |
3. الکترولیز اکسید جامد
در الکترولیزهای اکسید جامد، سلول در دماهای بسیار بالاتری نسبت به الکترولیزهای قلیایی و غشای تبادل پروتون در محدوده دمای 900 تا 1000 درجه سانتیگراد کار میکند. الکترودهای سلولی از نیکل ساخته شدهاند و برای فرآیند جداسازی هیدروژن به الکتریسیته کمتری نیاز است، که این فرایند در شکل 3 نشان داده شده است ]11[. میتوان از منابع ورودی حرارتی مختلف، همچون حرارت هدررفت و انرژی هستهای، برای کاهش وابستگی به الکتریسیته برای گرمایش استفاده کرد ]12[. علاوه بر این، راندمان سلول با دمای عملیاتی بالاتر افزایش مییابد. متأسفانه دماهای بالا نیز سرعت تخریب الکترولیت را افزایش داده و طول عمر سلولها را کاهش میدهد.
 |
||
| شکل 3 الکترولایزر اکسید جامد |
4. الکترولیز غشای تبادل آنیونی
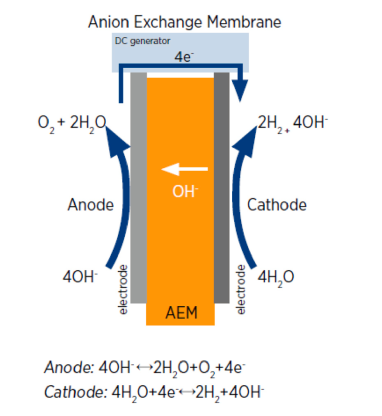
این دسته از فناوری الکترولیز، جدیدترین فناوری الکترولیز آب میباشد که عمدتاً توسط کاربردهای الکتروشیمیایی برای تولید هیدروژن در چند سال گذشته استفاده میگردد. الکترولیزهای غشای تبادل آنیونی مزایای الکترولیزهای آب قلیایی و غشای تبادل پروتون را ترکیب می کنند ]13[. مکانیسم واکنش یک سلول در این فرایند در شکل 4 نشان داده شده است. همانطور که مشاهده می شود، هیدروژن و هیدروکسید در سمت کاتد تولید میگردند. علاوه بر این، مواد کاتالیزور غیر نجیب را می توان برای این سلولها استفاده کرد که منجر به کاهش هزینه های تولید هیدروژن میگردد]14[. با این حال، عملکرد این فرایند به دلیل فعالیت ضعیف کاتالیزور و رسانایی پایین غشاء همچنان پایین است. بنابراین، این الکترولیز آب به تحقیقات بیشتر، به ویژه در مورد مواد غشایی، هزینه سلول، و کارایی نیاز دارد. واضح است که الکترولیزهای اکسید جامد و غشای تبادل آنیونی کماکان در مرحله تحقیق و توسعه هستند و در مقایسه با فناوریهای قلیایی و غشای تبادل پروتون از توسعهیافتگی کمتری برخوردار هستند. علاوه بر این، مزایای غشای تبادل آنیونی شامل هزینه کلی پایینتر و پایداری تولید هیدروژن بالا میباشد ]15[.
 |
||
|
|
|
شکل 4 شماتیک الکترولیز غشای تبادل آنیونی |
مراجع
[1] J.C. Ganley, High temperature and pressure alkaline electrolysis, Int. J. Hydrogen Energy 34 (2009) 3604–3611.
[2] A. Ursua, L.M. Gandia, P. Sanchis, Hydrogen production from water electrolysis: current status and future trends, Proc. IEEE 100 (2012) 410–426.
[3] H. Wendt, H. Hofmann, Ceramic diaphragms for advanced alkaline water electrolysis, J. Appl. Electrochem. 19 (1989) 605–610
[4] C.K. Kjartansdottir, ´ L.P. Nielsen, P. Møller, Development of durable and efficient electrodes for large-scale alkaline water electrolysis, Int. J. Hydrogen Energy 38 (2013) 8221–8231.
[5] J. O Jenson, V. Bandur, L. Yde, Pre-Investigation of Water Electrolysis, 2008.
[6] D. Ferrero, A. Lanzini, M. Santarelli, P. Leone, A comparative assessment on hydrogen production from low- and high-temperature electrolysis, Int. J. Hydrogen Energy 38 (2013) 3523–3536.
[7] P. Millet, R. Ngameni, S.A. Grigoriev, N. Mbemba, F. Brisset, A. Ranjbari, et al., PEM water electrolyzers: from electrocatalysis to stack development, Int. J. Hydrogen Energy 35 (2010) 5043–5052
[8] J. Rossmeisl, Z.W. Qu, H. Zhu, G.J. Kroes, J.K. Nørskov, Electrolysis of water on oxidesurfaces, J. Electroanal. Chem. 607 (2007) 83–89.
[9] A. Godula-Jopek (Ed.), Hydrogen Production by Electrolysis, Wiley- VCH, Weinheim, 2015.
[10] IRENA, Green Hydrogen Cost Reduction: Scaling up Electrolyzers to Meet the 1.5⁰C Climate Goal, International Renewable Energy Agency, Abu Dhabi, 2020.
[11] V. Utgikar, T. Thiesen, Life cycle assessment of high temperature electrolysis for hydrogen production via nuclear energy, Int. J. Hydrogen Energy 31 (7) (2006)
939–944.
[12] J.R. Varcoe, P. Atanassov, D.R. Dekel, A.M. Herring, M.A. Hickner, P.A. Kohl, et al., Anion-exchange membranes in electrochemical energy systems, Energy Environ. Sci. 7 (2014) 3135–3191.
[13] Y. Leng, G. Chen, A.J. Mendoza, T.B. Tighe, M.A. Hickner, C.-Y. Wang, Solid-state water electrolysis with an alkaline membrane, J. Am. Chem. Soc. 134 (2012)
9054–9057.
[14] C.C. Pavel, F. Cecconi, C. Emiliani, S. Santiccioli, A. Scaffidi, S. Catanorchi, et al., Highly efficient platinum group metal free based membrane-electrode assembly for anion exchange membrane water electrolysis, Angew. Chem. Int. Ed. 53 (2014) 1378–1381
[15] W. Xu, K. Scott, The efects of ionomer content on PEM water electrolyser membrane electrode assembly performance, Int. J. Hydrogen Energy 35 (2010)
12029–12037.